CONDUCIBILITA’ DI UNA SOLUZIONE ELETTROLITICA
Scopo dell’esperimento. Determinare la dipendenza della conducibilità di una soluzione elettrolitica dalla sua concentrazione.
Materiale occorrente.
| generatore di corrente | |
| multimetro usato come amperometro | |
| apparecchiatura per conducibilità munita di elettrodi |
| cavi di collegamento | |
| vetrini da orologio | |
| cloruro di sodio | |
| spruzzetta con acqua distillata | |
| bilancia elettronica (sensibilità 1mg) |

Fig 1: L’apparecchiatura per la conducibilità è costituita da una vaschetta di vetro con immerse due lastrine di rame o di zinco. L’apparato prende il nome di cella elettrolitica. Le due latrine di rame sono gli elettrodi della cella. Si chiama anodo l’elettrodo collegato al polo positivo del generatore, catodo quello collegato al polo negativo.
Richiami teorici. Prendono il nome di elettroliti tutte le sostanze dissociabili in ioni. Sono quindi elettroliti gli acidi, le basi e i sali. Le soluzioni acquose di elettroliti (soluzioni elettrolitiche), grazie al fatto che questi si dissociano in ioni, conducono la corrente elettrica. Il cloruro di sodio, come tutti i sali, allo stato cristallino è isolante. In acqua i cristalli di NaCl si scindono negli ioni che li costituiscono: lo ione positivo sodio (Na+) e lo ione negativo di cloro (Cl-). Particolarmente interessante risulta la determinazione della relazione esistente tra la concentrazione della soluzione elettrolitica e l’intensità della corrente elettrica che attraversa la soluzione. Si rammenta che le soluzioni elettrolitiche sono classificate come conduttori di seconda specie (quelli di prima specie sono i metalli).
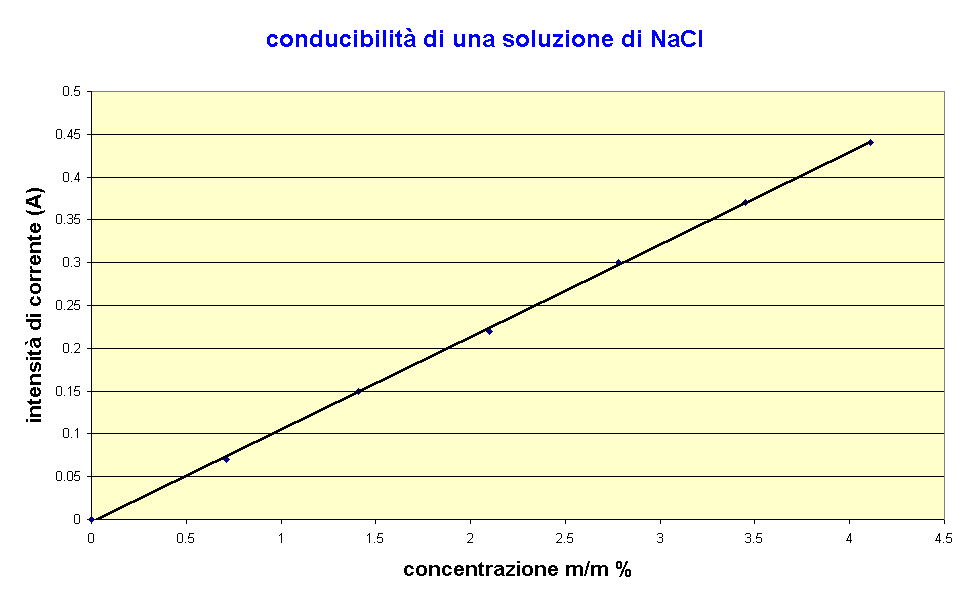
Esecuzione dell’esperimento. Si monta l’apparecchiatura per determinare la conducibilità come mostrato nella figura 1. In 6 vetrini si preparano 500 mg ciascuno di cloruro di sodio e si verifica la giusta quantità con la bilancia elettronica. Si versa nell’apparecchiatura per conducibilità 70 grammi di acqua distillata e si scioglie il contenuto di uno dei vetrini mescolando con una bacchetta di vetro. Si chiude il circuito e si legge sul multimetro il valore dell’intensità di corrente. Si ripetono le operazioni precedenti sciogliendo di volta in volta il contenuto dei vetrini rimanenti. Si riporta un esempio delle misure effettuate nella seguente tabella:
| massa NaCl (g) |
Concentr. M/m % |
I (A) | I/Conc |
| 0 | 0 | 0 | 0 |
| 0.5 | 0.71 | 0.07 | 0.099 |
| 1.0 | 1.41 | 0.15 | 0.106 |
| 1.5 | 2.10 | 0.22 | 0.105 |
| 2.0 | 2.78 | 0.30 | 0.108 |
| 2.5 | 3.45 | 0.37 | 0.107 |
| 3.0 | 4.11 | 0.44 | 0.107 |
Nota: Si ricordi che per determinare la concentrazione espressa in m/m % si deve risolvere la seguente proporzione:
massa del soluto (g) : massa della soluzione (g) = x : 100
altre misure: conducibilità del solfato di rame
Considerazioni finali. Durante l'esperimento si noterà che la soluzione
assume una colorazione verda- stra e, inoltre, in corrispondenza degli
elettrodi si osserverà lo sviluppo di bollicine.
Questi fenomeni dimostrano che il passaggio della corrente nella soluzione determina una
reazione chimica nella soluzione stessa. In particolare la formazione delle bollicine
indica che si ha la formazione di un gas, probabilmente idrogeno molecolare o anidride
carbonica. Per quanto riguarda i dati raccolti ed elaborati risulta evidente che tra
l'intensità della corrente e la concentrazione della soluzione vi è una relazione di
proporzionalità diretta poiché il loro rapporto è pressoché costante.
Data ultimo aggiornamento 17/03/02
Aggiornato da Valter Giuliani
Indirizzo di posta elettronica: giuliani@fisicachimica.it